代寫計算機碩士論文題目:基于異質圖學習的藥物副作用聚類探討

本文是一篇計算機碩士論文,本研究圍繞藥物副作用的多組學異質網絡分析,系統性地提出了一套融合異質圖神經網絡與多模態聚類算法的創新性研究框架。
1緒論
1.1課題研究背景及研究意義
藥物發現與設計是耗資大、周期長、風險高、成功率與效率低的系統工程[1],新藥的研發全過程如圖1-1所示。據統計,一個新藥從初始概念到投放市場平均耗時10~15年,平均花費是8~15億美元,盡管如此,每年也僅有約10%藥物獲得美國食品和藥物管理局(food&drug administration,FDA)認證[2-4]。2013年之前,每年被該機構認證的新藥約20種[5]。如果是癌癥藥物,其花費更高,達到10-20億美元,但是仍有90%以上的化合物無法通過臨床檢驗[6]。
藥物不良反應(Adverse Drug Reactions,ADRs)是指在正常用藥過程中出現的有害非預期反應[7],其導致超過20%的臨床試驗失敗,并被視為現代藥物研發過程中的主要負擔[8,9]。嚴重的藥物不良反應可能導致患者重度殘疾甚至死亡。在歐洲,約3.6%的住院病例由ADR引起,且高達10%的住院患者曾經歷ADR[9]。在美國,估算數據顯示每年住院患者中發生超過200萬例嚴重ADR,并導致10萬人以上死亡[10,11]。2016年,美國因藥物相關疾病造成的年度經濟成本估計達5284億美元,相當于當年全美醫療總支出的16%[12]。藥物不良反應引發的藥物臨床試驗失敗主要原因是藥物在臨床應用前需經過動物實驗和大批量人體臨床試驗以識別潛在不良反應;然而,由于上市前試驗的樣本量有限、試驗周期不足,以及眾多可能的副作用和藥物組合,許多不良反應在藥物研發早期階段難以被發現[13]。
1.2國內外研究現狀
在提高異質圖神經網絡算法的改進與應用和聚類算法的性能方面,許多國內外學者一直以來堅持不懈的做著研究工作。與本文工作相關的國內外研究現狀一共分為以下兩部分:異質圖神經網絡算法的國內外研究現狀以及聚類分析技術的國內外研究現狀。
1.2.1異質圖神經網絡算法研究現狀
復雜系統中的許多現實數據天然適合用異質圖表示,其中多種類型的實體及其關系分別體現為不同類型的節點和邊[24]。
異質圖(heterogeneous graph)通過多類型節點和邊揭示了其蘊含的語義信息。過去十年間,異質圖學習獲得了廣泛關注。早期研究通常結合skip-gram模型[25]和元路徑引導的隨機游走[26-28]。隨著深度學習的快速發展,圖神經網絡(GNNs)[29-31]被提出以融合節點特征并受益于神經網絡架構。最初GNNs專注于同質圖,但研究者很自然地將GNNs推廣到異質場景,其中多種類型的節點和邊為GNN設計引入了額外的復雜性。
而后,多種異質圖神經網絡(HGNNs)已被提出用于捕捉語義信息,在異質圖表征學習方面取得了卓越性能[32-36]。HGNNs是眾多應用領域的核心,包括社交網絡分析[37]、推薦系統[38,39]和知識圖譜推理[40-42]。
2研究路線及相關技術
2.1研究路線
本研究的技術路線遵循“數據整合→特征學習→聚類驗證”的遞進邏輯,各環節通過生物醫學問題驅動形成緊密閉環,具體流程如圖2-1所示。
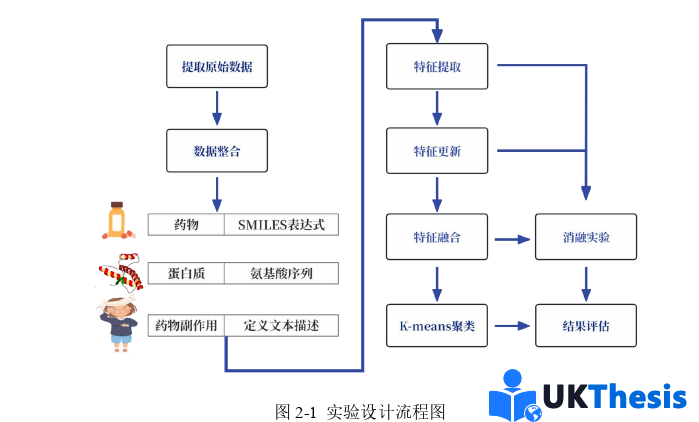
研究起始于多源數據的系統性整合:從DrugBank[101]、HuRI[102]、SIDER[103]三大數據庫提取原始數據后,通過第三方數據庫構建不同數據庫間實體映射關系,構建涵蓋藥物、蛋白質、副作用的異質網絡,該網絡包括藥物-藥物、藥物-蛋白質、藥物-副作用及蛋白質-蛋白質四種不同互作關系。此階段通過數據清洗(如過濾無效副作用)從源頭保障了后續分析的可靠性,同時通過標識符統一(如PubChemCID構建DrugBank、SIDER數據庫間藥物不同標識符映射關系)解決了多組學研究中的“數據孤島”難題,為異質圖構建奠定了基礎。
2.2圖機器學習理論
2.2.1同質圖神經網絡
在傳統同質圖分析方法中,圖神經網絡(Graph Neural Networks,GNN)已成為最主流的解決方案。這類網絡架構專為處理具有圖結構的數據而設計[109]。現實世界中的諸多復雜系統,包括社交關系網、藥物相互作用網以及分子化學結構等,均可建模為圖數據結構,其中節點代表每個系統的基本組成單元,邊則代表基本單元間的相互作用關系。GNN的核心價值在于其能夠有效捕捉頂點間的非線性關聯以及圖的整體拓撲特征[109]。該技術通過節點嵌入機制實現這一目標,其中每個節點的特征向量都是通過聚合其相鄰節點的信息而生成的,這種局部信息融合策略使得每個節點都具有其局部網絡結構的特性[109]。通過多輪迭代優化,節點的特征嵌入會逐步整合更廣泛鄰域空間的信息,最終形成能夠反映其在全局網絡中拓撲結構的高維特征向量。
圖神經網絡的核心是通過消息傳遞機制(Message Passing)實現節點特征學習。其框架可分為四個關鍵步驟:
GNN專為處理僅含單一類型節點和邊的同質圖而設計,采用鄰域聚合機制來獲取圖結構信息——通過遞歸聚合相鄰節點特征的方式來計算每個節點的特征嵌入。然而,GNN難以有效處理兼具豐富語義信息和結構信息的異質圖。由此,異質圖神經網絡相關算法不斷出現。異質圖神經網絡(Heterogeneous Graph Neural Network)與同質圖神經網絡最大區別在于異質圖中包含節點異質性和關聯多樣性。
3基于藥物多組學異構網絡的數據整合與特征對齊研究......................27
3.1引言................................27
3.2藥物多組學異構網絡標準數據集........................28
4基于Bi-LSTM和RWR交叉注意力的藥物副作用聚類分析算法..........................38
4.1基本思路...................................38
4.2基于Bi-LSTM的特征學習.............................39
5基于元路徑注意力機制的藥物副作用聚類分析方法..........53
5.1基本思路...............................53
5.2元路徑設計.................................54
5基于元路徑注意力機制的藥物副作用聚類分析方法
5.1基本思路
本研究在異質圖神經網絡的特征學習方面提出了兩種不同邏輯的方法體系,形成全面的技術探索。
在第四章中,創新性地將異質圖信息解構為三個關鍵維度:通過Bi-LSTM捕捉同種節點間的序列依賴關系,利用注意力機制建模不同節點類型的語義交互,并引入隨機游走重啟策略提取網絡的拓撲結構特征。這三個維度的特征通過交叉注意力機制進行深度融合,其中轉移概率矩陣作為圖結構的先驗知識指導特征聚合過程。消融實驗證實,這種基于關系的學習框架中每個模塊都對最終聚類性能具有顯著貢獻。
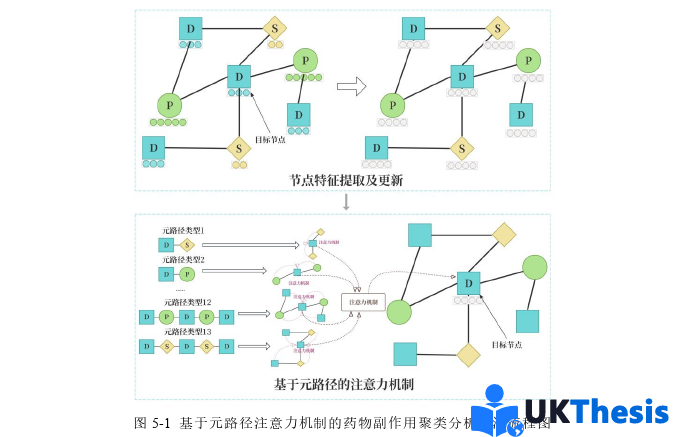
第五章則轉向基于元路徑的異質圖學習方法,與第四章形成方法論的對比研究。具體而言,在第三章通過自然語言處理的方式提取異質節點各自生物信息學特征并進行維度統一處理的基礎上,本章首先將異質節點構建為異質圖,隨后基于領域知識設計關鍵元路徑,在每條元路徑上采用圖注意力機制進行鄰域特征聚合,獲得路徑特定的節點表示。隨后通過元路徑級別的注意力層,動態學習不同語義路徑的重要性權重,最終生成融合多路徑信息的節點嵌入。這種分層注意力架構(節點級+路徑級)能夠自適應地捕捉異質圖中復雜的語義關聯,如圖5-1所示。
6總結與展望
6.1工作總結
本研究圍繞藥物副作用的多組學異質網絡分析,系統性地提出了一套融合異質圖神經網絡與多模態聚類算法的創新性研究框架。在方法學層面,本研究的主要貢獻體現在三個關鍵環節:
在數據整合與特征工程方面,通過構建藥物-蛋白質-副作用三元異質網絡,創新性地解決了多源生物醫學數據的標識符異構性問題。研究采用Drug-smile-fet模型、3-gram蛋白質序列分析和sentence-BERT文本嵌入等技術,實現了跨模態特征的深度語義提取,并通過去噪自編碼器(DAE)完成了特征空間的統一對齊,為后續分析提供了高質量的多維特征表示。
在異質圖特征學習方面,本研究提出了兩種不同的技術路線:第四章中使用的Bi-LSTM與RWR注意力機制融合模型,有效整合了序列特征與拓撲結構信息;第五章設計的基于元路徑的異質圖神經網絡,則通過分層注意力機制捕捉高階語義關聯。兩種方法分別從局部互作和全局路徑的角度,為藥物副作用分析提供了多維度的特征表示。
在聚類分析環節,盡管藥物副作用缺乏合適的真實標簽,在研究中仍然通過肘部法則與多指標驗證確定了最優聚類方案。消融實驗結果表明,本研究提出的框架在內部評價指標上取得顯著提升,且聚類結果展現出良好的生物學可解釋性,為藥物安全預警和副作用機制研究提供了新的分析工具。
本研究的創新價值不僅體現在具體的技術改進,更重要的是建立了一套可擴展的藥物多組學分析范式,為后續研究提供了方法論參考。未來工作可進一步拓展到藥物重定位、多藥聯用安全性評估等應用場景。
參考文獻(略)