醫學類碩士論文范文代寫:羅哌卡因脂質體的制備及抗腫瘤活性探討

本文是一篇醫學類碩士論文,本研究突破傳統局麻藥單模態鎮痛的技術局限,開發了基于脂質體載體的羅哌卡因緩釋系統。實現藥物在腫瘤部位的被動靶向富集(EPR效應)與緩釋。在保障圍術期鎮痛需求的同時,顯著提升腫瘤局部藥物濃度。實現了精準麻醉與抗腫瘤治療的雙重功能。
1圍手術期麻醉管理對腫瘤轉移和復發的影響
1.1手術對腫瘤轉移和復發的影響
手術是實體瘤患者的主要治療手段,其本身具有雙重效應:一方面能夠切除原發灶,另一方面可能通過多重機制促進腫瘤復發和轉移,進而增加發病率和死亡率[11]。從生物學機制來看,手術操作中的機械牽拉可直接導致循環腫瘤細胞(CirculatingTumor Cells,CTCs)播散[12,13]。同時手術創傷應激會激活下丘腦-垂體-腎上腺軸(HPA),引發皮質醇、前列腺素E2(Prostaglandin E2,PGE2)等免疫抑制因子釋放,打破Th1/Th2免疫平衡并抑制自然殺傷細胞(NK細胞)活性,形成利于殘留癌細胞免疫逃逸的微環境[14]。而CTCs在多數實體腫瘤患者中均可檢測到,且其數量升高與多種腫瘤類型的不良預后密切相關[15]。
腫瘤細胞的播散可通過血液、淋巴或經體腔(一種跨越體腔或器官表面包括胸膜或腹膜表面的腫瘤轉移途徑)途徑發生。使用實時熒光成像已經觀察到腫瘤細胞可通過手術破壞淋巴管播散[16]。臨床前研究表明,腫瘤間質高壓環境通過促進淋巴引流加速癌細胞轉移,該過程可被手術創傷引發的炎癥級聯反應顯著放大:手術造成的血管內皮損傷導致間質靜水壓異常升高,引發間質水腫并增強殘余腫瘤細胞的淋巴遷移能力[17]。而在腹腔手術中,消化道及婦科惡性腫瘤(結直腸/胰腺/卵巢癌)在腹腔手術后更易發生體腔種植轉移,臨床前模型證實該機制促進腹膜轉移灶形成[18]。此外,手術過程中二氧化碳氣腹(用于輔助腹腔鏡手術)導致的干燥作用可能進一步加速腫瘤的腹腔擴散[19],其手術操作本身也可能直接誘發腫瘤細胞播散。例如,使用腹腔鏡端口可能導致端口部位復發:在胃腸道[20]及泌尿系統[21]等惡性腫瘤術后均有出現。且在意外診斷的膽囊癌切除術患者中,其發生率超過10%[22]。
1.2麻醉對腫瘤轉移和復發的影響
腫瘤治療的圍手術期管理中,麻醉策略作為核心要素通過雙重機制影響腫瘤進程:其作用不僅限于緩解手術創傷,更關鍵的是調控“腫瘤侵襲潛能-宿主免疫屏障”動態平衡系統。研究表明,特定麻醉藥物及技術方案通過調節循環腫瘤細胞活性和重塑免疫微環境等方式直接干預微轉移。
在臨床麻醉中,吸入麻醉藥(如七氟醚、異氟醚、地氟醚)與靜脈麻醉藥丙泊酚對腫瘤生物學行為的影響已獲得多維度證據支持。研究顯示吸入麻醉藥可通過調控IL-17和TNF信號通路及其相關轉錄因子促進腫瘤轉移,其應用還與皮質醇及促腎上腺皮質激素水平升高存在關聯[38],并通過抑制Mac-1、Ras相關蛋白1(Ras-relatedprotein 1,Rap1)和TLR4等分子顯著削弱中性粒細胞的吞噬功能[39]。與丙泊酚聯合區域阻滯技術相比,接受吸入麻醉患者的術后血清顯示出更強的腫瘤細胞活性刺激作用及NK細胞活性抑制效應。盡管揮發性麻醉劑通過誘導HIF-1a表達對缺血再灌注損傷具有保護作用,但在腫瘤手術中可能增加惡性復發風險,特別是在前列腺癌和腎細胞癌中,異氟烷介導的缺氧誘導因子(Hypoxia-Inducible Factor,HIF)表達上調與癌細胞遷移增殖密切相關[40]。相比之下,丙泊酚作為主流靜脈麻醉藥展現出潛在抗腫瘤特性。其抗炎作用與免疫激活效應可能通過多種機制實現:在乳腺癌手術中促進腫瘤微環境內NK細胞和輔助性T細胞浸潤[41]、維持術后血清中NK細胞活性水平[42]。分子機制研究揭示丙泊酚可抑制NET1、SOX4等促癌基因表達,降低前列腺癌細胞雄激素受體表達,并通過下調HIF-1a抑制腫瘤血管生成[40,43]。不過現有研究結論尚未形成統一共識,其臨床獲益仍需通過前瞻性研究進一步驗證。
2實驗方法
2.1溶液配制
2.1.1 1mg/mL的IR780溶液
使用分析天平(精度0.001 mg)準確稱取IR780粉末,溶于氯仿中,制備成濃度為1 mg/mL的母液。將混合液轉移至數控超聲清洗機中,以40 kHz頻率超聲30分鐘,確保染料充分溶解并分散均勻。溶液轉移至棕色樣品瓶后,采用封口膜密封,外層包裹錫紙以隔絕光線,最終于4℃冷藏保存備用。
2.1.2 PBS緩沖液
準確稱取0.01 M磷酸鹽緩沖液粉末,溶解于150 mL去離子水中,磁力攪拌至完全溶解后定容至200 mL,獲得10×PBS濃縮液。取20 mL 10×PBS母液,加入180mL去離子水混合均勻,靜置10分鐘以獲得滲透壓穩定的1×PBS溶液。將1×PBS溶液分裝至無菌樣品瓶,經121℃高壓蒸汽滅菌15分鐘,密封后標記配制日期。避光條件下,保存于4℃冰箱。
2.1.3完全培養基
在超凈工作臺內,向預熱至37℃的DMEM基礎培養基中依次加入體積分數10%的胎牛血清(FBS)、1%HEPES緩沖液、1%L-谷氨酰胺及0.5%青霉素-鏈霉素雙抗(A/P,100×儲存液)。采用移液器輕柔吹打10次(避免氣泡產生),使各組分充分混合,密封后置于4℃避光保存。
2.2納米粒子的制備
2.2.1空載脂質體的制備
精確稱取卵磷脂(160 mg)與膽固醇(20 mg)(質量比8:1),溶解于氯仿-無水乙醇混合溶劑(1:1,v/v,40 mL)中。將混合液轉移至100 mL圓底燒瓶,經輔助超聲處理(40 kHz,15 min)實現脂質分子均質分散。隨后采用旋轉蒸發儀(40℃,80rpm)減壓旋蒸40 min,待溶劑完全揮發后形成乳白色脂質薄膜。向燒瓶內注入10 mL超純水,于45℃恒溫水浴中超聲水化10 min(功率80 W),促使脂質薄膜脫落并分散均勻,將粗懸液轉移至冰浴預冷的50 mL離心管,采用探頭式超聲細胞破碎儀以脈沖模式(工作4 s/間歇3 s)處理30 min,全程維持體系溫度≤10℃。超聲處理后懸液經4000 rpm離心10 min,有效去除鈦合金探頭磨損產生的金屬碎屑及未包封脂質碎片。收集上清液(即空載脂質體)。
2.2.2 R@L的制備
將Rop溶液(濃度0.5%)作為水化介質替代超純水,參照上述Lip制備流程,最終獲得R@L溶液。
2.2.3 RI@L的制備
在R@L合成初始階段,向含脂質薄膜的圓底燒瓶中共注入1 mL IR780氯仿溶液(1 mg/mL),形成IR780-脂質分子共混體系。采用避光共包埋策略(全程錫紙覆蓋反應容器),然后再按照上述Lip制備流程,即可得到RI@L溶液。將其外層以錫紙避光包裹,于4℃冷藏保存。
3 統計學方法................................. 27
4 技術路線圖................................... 28
5 實驗結果 ............................... 29
5.1 納米粒子的表征研究 ............................... 29
5.2 RI@L的體外釋藥研究 ................................... 32
5.3 RI@L的體外熒光成像及光熱性能研究 ............ 34
6討論
6.1脂質體的特征
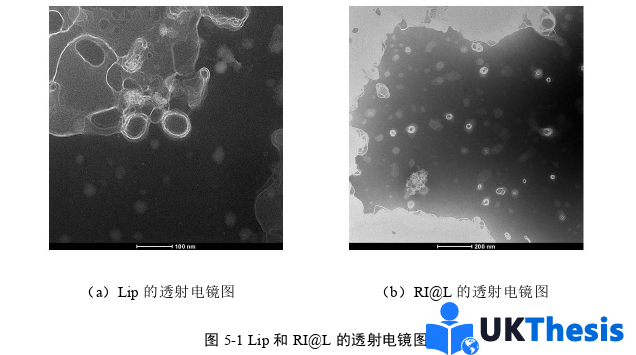
脂質體粒徑作為關鍵參數,在抗腫瘤藥物遞送中具有雙重調控作用:影響腫瘤組織的靶向蓄積效率的同時,又決定體內循環特性。研究證實,粒徑參數通過以下機制發揮核心調控功能:首先,粒徑大小直接關聯腫瘤血管穿透能力[105],其次,與血液循環持續時間共同決定腫瘤組織的最終蓄積水平[106]。脂質體化抗腫瘤藥物的療效與毒性特征均呈現顯著的粒徑依賴性;當粒徑小于100 nm時,循環時間縮短主要源于肝血竇毛細血管(平均孔徑100 nm)對小粒徑載體的高通透性,導致肝實質細胞攝取增加[107]。當粒徑超過100 nm時,肝脾吞噬系統的快速清除成為主導因素[108]。Liu團隊在EMT6(小鼠乳腺癌細胞系)腫瘤模型中系統揭示了粒徑-蓄積的量化規律:90-200 nm粒徑范圍的脂質體可能同時具備最優腫瘤蓄積量和血液長循環特性,證實循環持續時間與腫瘤蓄積效率存在直接正相關[108]。載體表面特性需協同滿足兩大要求:通過構建親水性中性及弱負電界面降低血漿蛋白吸附,延緩巨噬細胞吞噬[109]。通過弱負電或適度正電修飾減少與負電性生物界面的電荷排斥[110],此發現為表面電荷調控提供了重要理論依據。而本課題所制備的RI@L粒徑在Pbs及10%FBS中均能穩定在200 nm以內,且表面帶有少量負電荷,兼具血液長循環與腫瘤靶向蓄積的結構基礎。此外,通過透析法測得藥物在體外穩定緩慢釋放,直至24 h左右實現完全釋放,證明其具有優異的緩釋效果。
結論
1、成功制備了Rop&IR780@Lip脂質體,粒徑約為150 nm,并具有良好的穩定性。
2、合成的Rop&IR780@Lip脂質體細胞毒性低、溶血率極低、在體內和體外均具有良好的生物相容性。
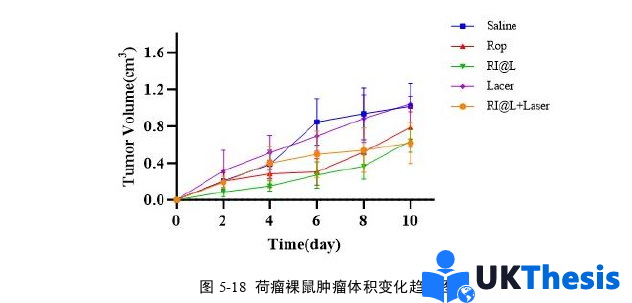
3、本研究構建的Rop&IR780@Lip納米遞送系統通過EPR效應實現腫瘤靶向富集,具有一定的抗腫瘤活性。
4、本研究結果為圍術期精準實施區域神經阻滯聯合腫瘤微環境調控提供了參考,其鎮痛-抗腫瘤協同效應有望為麻醉方案的選擇提供一定指導。
參考文獻(略)